氰硫氨水等腐蚀脱硫塔内壁减薄解决是方法和维修改造
|
氰硫氨水等腐蚀脱硫塔内壁减薄解决是方法和维修改造
焦化厂脱硫塔浆液中包含的介质:水、氢离子、氨、H2S、硫化物、氰化、氟化氢、氯离子、焦油、各种催化剂。
其中主要腐蚀介质是:氨NH3、硫化氢H2S、氰化HCN。
包含的离子介质:NH3、NH4 、OH—、HS—、H2S、HCN、F-、CL-、
一、氨水腐蚀介绍
氨水是含氨25%~28%的水溶液,即一水合铵,氨水中存在的离子:H2O、NH3、NH4 、OH-和极少量H 组成的混合物。
氨溶于水时,大部分NH3与H2O通过氢键结合,形成一水合氨,氨水可以部分电离成NH4 和OH-,所以氨水显弱碱性;同时氨水中有少量氢离子的存在,氨水具有一定的酸性,所以氨水既有碱腐蚀也有酸腐蚀。

氨水腐蚀金属三个原因:
一是金属与金属离子存在双电平衡;
二是氨分子可以与许多金属离子形成稳定的配离子;
三是大气中含有大量的氧分子。
氮原子有孤电子对,有跟其他分子或离子形成配位键的倾向,可以和具有空轨道的分子或离子形成配位键,易与他们离子形成络合物,得到各种形式的氨合物。
氨可以与许多金属离子形成比较稳定的配位物,会使金属离子与金属单质之间的标准电极电势降低,配合物通常稳定性比金属离子更高,所以金属单质更容易被氧化。
液氨能与活泼的金属反应,在此过程中,NH3表现出弱的氧化性。而氨对金属的的腐蚀作用中,腐蚀金属的是大气中的氧分子,氨分子本身没有发生氧化还原反应, 氨分子只是介质,其作用是使得腐蚀更容易进行。
焦化厂脱硫塔中,用浓氨水不断喷淋,同时塔底部会不断有新鲜空气进入,并流入脱硫塔中,导致脱硫塔中源源不断有氧气进入,导致氨腐蚀持续进行。
二、硫化氢腐蚀
干燥的H2S对金属材料无腐蚀破坏作用,H2S只有溶解在水中才具有腐蚀性。
H2S溶于水,立即电离使水具有酸性,释放的氢离子极易在阴极夺取电子,使管材受到电化学腐蚀,促进阳极铁溶解而导致钢铁的腐蚀。
腐蚀过程中产生的氢原子被钢铁吸收后,提高了钢铁表面氢浓度,加速了氢向钢中的扩散溶解过程,导致钢材脆化,萌生裂纹,导致开裂,形成氢鼓包腐蚀,
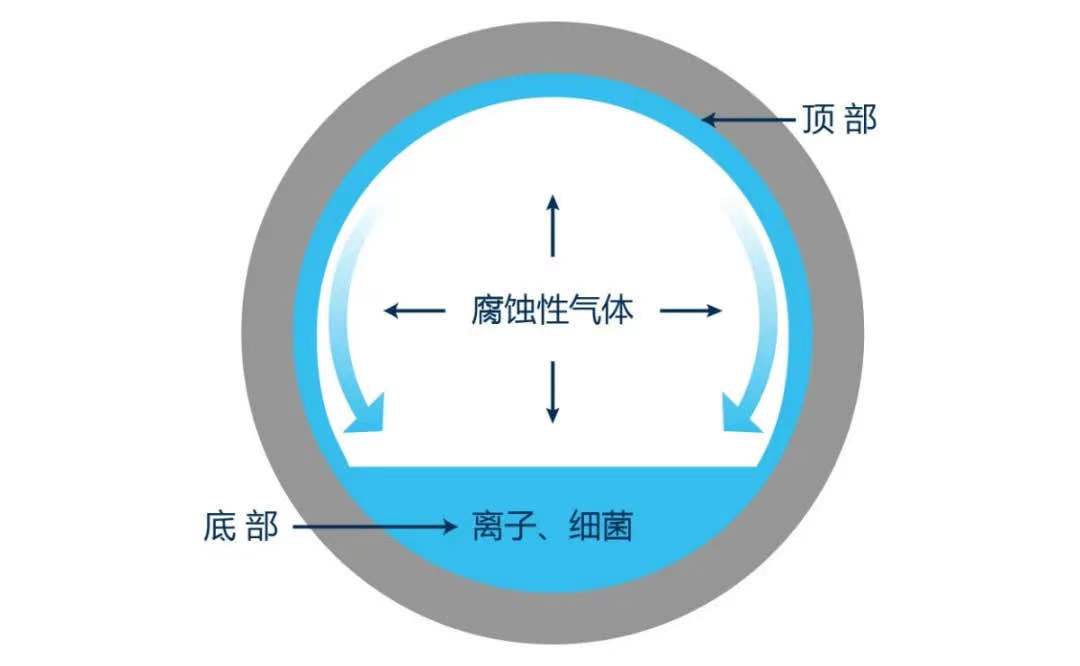
氨与硫化氢共同作用,腐蚀会加剧,形成应力腐蚀开裂
H2S-NH3-H2O型腐蚀,影响此形式腐蚀的主要因素有:
a. NH3 和H2S 的浓度越高, 腐蚀越严重;
b. 流体介质的流速越高, 腐蚀趋剧烈; 当然流速过低, 会使铵盐沉积, 导致基材表面局部垢下腐蚀;
c. 某些介质存在的影响, 如氰的存在, 对腐蚀将产生强烈影响, 氧的存在也会加速腐蚀。
三、HCN腐蚀
HCN,弱酸,氰酸是有挥发性和腐蚀性的液体。有强烈的乙酸气味。标准状态下为液体。其水溶液沸腾时,部分水解而生成甲酸铵,HCN对不锈钢有可能产生晶间腐蚀,也有可能是应力腐蚀,由于HCN的酸性比碳酸弱,比碳酸氢根强,因此不能与碳酸盐反应放出CO2。
脱硫塔的脱硫浆液中含有H2S、NH3、CN-,这些物质或它们之间的反应产物成为主要的腐蚀性介质,构成H2S-NH3-HCN-H2O腐蚀环境,
Fe H2S-FeS H
钢铁在H2S水溶液中,不只是由于电化学反应生产FeS而引起的一般腐蚀,而是生成的氢原子还向钢铁渗透并扩散。渗入钢中的氢原子一部分分散在金属晶格内,另一部分向金属缺陷处扩散蓄积,形成氢分子,而这些氢分子存在于钢中,使钢发生脆化。由于氢分子的不断蓄积,导致该处压力升高,内应力增加,致使钢板分层、鼓泡、甚至开裂,形成氢脆。
当Ph值为6时,钢表面被FeS覆盖,有较好的保护性能。但存在CN、CL等活性离子时,溶解了FeS保护层,加速了基材腐蚀。
FeS 6CN-=[Fe(CN)6]4- S2-
[Fe(CN)6]4- 2Fe2 =Fe2[Fe(CN)6](沉淀)
脱硫浆液中含有的NH3、CN-,它们能与H2S发生反应,生产硫化铵、硫化氢铵,是腐蚀性较强的物质。
H2S NH4OH→NH4HS H2O
NH4HS NH4OH→(NH4)2S H2O
硫化铵(NH4)2S能使硫化氢在水中的溶解度大大增加,提高硫化氢的浓度。另一方面,氨溶于水后,提高了水的PH值,为氰离子与FeS的反应提供了更有利的条件,造成钢基材厚度减薄、局部穿孔,另外极易引起鼓泡、开裂、焊缝应力腐蚀等现象。
综上所述,脱硫塔内腐蚀介质主要是氢离子、硫化氢、氨水腐蚀,这些分子都是小分子,渗透能力比较强,脱硫塔防腐主要以防渗为主,
对于脱硫塔下部浆液池防腐
底漆选用ZS-1034做底漆,采用ZS-711黑、1033作面漆进行防护
漆膜厚度控制在300到500微米。
脱硫塔中上部内壁、管件等其他配套设施,直接使用711黑、1033、1034其中一种产品防护即可。漆膜厚度300微米以上。




